VALNEVA: BIONTECH, MODERNA etc. mit Totimpfstoff-Forschung vor möglicher Ablösung
Weitere Forschungs- und Zulassungserfolge alles entscheidend

Weiterhin steht die Aktie von Valneva, und dies unseres Erachtens auch völlig zu Recht, unter dem sehr positiven Eindruck der jüngsten Ergebnisse der klinischen Phase 3-Vergleichsstudie ihres Corona-Totimpfstoffkandidaten VLA2001 gegenüber dem von AstraZeneca entwickelten und bereits seit längerem marktzugelassenen Vektorimpfstoff AZD1222. Doch auch hinter den bisher eingeführten mRNA-Impfstoffen von BioNTech, Moderna und Johnson & Johnson sowie erst recht den weiteren aktuellen Todimpfstoff-Entwicklern Sanofi, Novavax und Sinovac muss sich Valneva unseres Erachtens in keinster Weise verstecken.
Denn auch in dieser Höhe völlig angemessen reagierte die Aktie von VALNEVA (FR0004056851) vor einer Woche am 18.10. mit einem Kurssprung um fast + 33 % auf die Nachricht, dass nach ersten Ergebnissen der mit über 4000 Teilnehmern durchgeführten klinischen Phase 3-Studie ihres Impfstoffkandidaten VLA2001 in einem direkt gegenüberstellenden Vergleich mit dem bereits seit Ende Januar 2021 international zugelassenen Vektorimpfstoff AZD1222 von ASTRAZENECA (GB0009895292) nicht nur gleichfalls in ähnlichen Dimensionen wie auch für die Zulassungsvoraussetzungen der Impfstoffe von BIONTECH (US09075V1026) und MODERNA (US60770K1079) die Immunisierungsrate von VLA2001 gegen anschließende Infektionen (sog. Serokonversionsrate) ab 2 Wochen nach Erhalt der zweiten Impfung bei 95 % gelegen hatte.
 Überdies, und hierin liegt natürlich die wesentliche Testergebnisüberlegenheit gegenüber dem Vakzin AZD1222 von AstraZeneca, war die infektionsabwehrende sog. Antikörpertiter-Bildung des menschlichen Immunsystems nach Verabreichung von VLA2001 um nicht weniger als 39 % höher gewesen als im Falle von AZD1222, während trotz der stärkeren Immunabwehr zugleich aber dennoch erheblich bessere Verträglichkeitsraten ausgewiesen wurden (nur in 73,2% aller Fälle Hautreaktionen nach der Injektion, verglichen mit 91,1 % beim AstraZeneca-Vakzin; ebenso auch nur in 70,2 % aller Fälle unerwünschte/übersteigerte Immunsystemreaktionen, im Falle von AstraZeneca dagegen ebenfalls auch hier in 91,1 % aller Fälle).
Überdies, und hierin liegt natürlich die wesentliche Testergebnisüberlegenheit gegenüber dem Vakzin AZD1222 von AstraZeneca, war die infektionsabwehrende sog. Antikörpertiter-Bildung des menschlichen Immunsystems nach Verabreichung von VLA2001 um nicht weniger als 39 % höher gewesen als im Falle von AZD1222, während trotz der stärkeren Immunabwehr zugleich aber dennoch erheblich bessere Verträglichkeitsraten ausgewiesen wurden (nur in 73,2% aller Fälle Hautreaktionen nach der Injektion, verglichen mit 91,1 % beim AstraZeneca-Vakzin; ebenso auch nur in 70,2 % aller Fälle unerwünschte/übersteigerte Immunsystemreaktionen, im Falle von AstraZeneca dagegen ebenfalls auch hier in 91,1 % aller Fälle).
Diese Testüberlegenheit des Valneva-Vakzinkandidaten VLA2001, die auch den ehemaligen klinischen Phase3-Testergebnissen der Impfstoffe von BioNTech (COMIRNATY) und Moderna (SPIKEVAX) annähernd ebenbürtig war, ist aus unserer Sicht in mehrfacher medizinischer Hinsicht überaus bemerkenswert.
Forschungsresultate verfahrensgleichen Konkurrenten sowie AstraZeneca klar überlegen
Denn bei VLA2001 handelt es sich aktuell weltweit um den ersten sog. Ganzkörper-Totimpfstoff (d.h. einen Impfstoff auf Herstellungsbasis über chemisch abgetötete und dadurch in ihrer weiteren Ausbreitungsfähigkeit deaktivierte SarsCov2-Virenstränge von tierischer Basisherkunft), der über die reine, in der Phase 3-Studie in 74,3 % aller Fälle gegebene Bekämpfung der sog. Spike- oder auch S-Proteine des Virus hinaus (= elementare Basis des Virus zum Andocken an und Eindringen in menschliche Körperzellen) auch noch weiter in 45,9 % aller Fälle die sog. Nucleo-/N-Proteine und in 20,3 % aller Fälle die sog. Matrix-/M-Proteine des SarsCov2-Virus ausschalteten.
Jegliche andere bisher entwickelte Vakzinkandidaten nach dem Totimpfstoff-Verfahren (was auch weltweit z.B. zur Entwicklung von Grippe- oder Hepatitis-Impfstoffen absolut gängig ist), wozu derzeit gerade auch die Impfstoffkandidaten von SANOFI (FR0000120578) und NOVAVAX (US6700024010) zählen, haben jedoch nach bisherigen Forschungsergebnissen bislang allein an der Außerkraftsetzung des S-Proteine des Virus (also dem Verhindern des Andockens an / Eindringens in menschliche Körperzellen) haltgemacht, ohne darüber hinaus jedoch noch jegliche weitere menschliche Immunzellenreaktionen gegen die weiteren M- und N-Proteine des Virus (also die eigentliche Symptomauslösung des Corona-Virus) hervorzurufen.
Insofern ist also offenbar bereits eine klinisch nachgewiesene klare Wirksamkeitsüberlegenheit von VLA2001 gegenüber ihren derzeit direktesten Totimpfstoff-Konkurrenten Sanofi und Novavax (und nicht zu vergessen dem ebenso strukturierten und z.B. seit Mai 2021 auch schon bereits von der europäischen EMA sondierten Impfstoffzulassung des chinesischen Herstellers SINOVAC) zu attestieren.
Auch dieser Umstand dürfte die seit 19.10. weiter angefachten Aktienumschichtungsbewegungen gerade zugunsten von Valneva nach kolportierten massiven aktuellen Produktionsproblemen von Novavax in den USA erheblich gefördert haben.
Dass der Valneva-Impfstoffkandidat VLA2001 nach den sehr beachtlichen Studienergebnissen in ihrer Infektionsverhinderungs- bzw. Immunabwehr-Wirksamkeit (und dies bei weit besserer Verträglichkeit, wie grundsätzlich bei praktisch allen Totimpfstoff-Verfahren im Vergleich zu aktiven mRNA- bzw. Vektor-Virenstrang-Verfahren einer BioNTech, Moderna, AstraZeneca etc. gegeben) aber offenbar selbst zu letzterem eine klar überlegene Wirkungseffizienz nachwies und damit auch bereits sehr nahe an die in ihren damaligen Markteinführungsstudien nachgewiesenen Wirkungsgrade von BIONTECH und MODERNA heranreicht, ist ein umso stärkeres Qualitätssiegel der bisherigen Forschungsergebnisse von VALNEVA, als jegliches Totimpfstoff-Verfahren gegenüber sonstigen Lebendimpfstoff-Verfahren unter Rückgriff auf aktive Virenstränge bei besserer Verträglichkeit natürlich im Normalfall fast durchweg nur deutlich geringere bzw. unterlegene menschliche Abwehr-Immunreaktionen auslöst (oder die Immunabwehrstärke von Aktivimpfstoff-Verfahren andernfalls nur bei deutlich höheren Wirkstoff-Konzentrationserhöhungen erreichen kann).
Starkes Konkurrenzpotenzial gegenüber allen Aktivvirus-Impfstoffentwicklern
Sollten sich diese bisherigen Studienresultate von VLA2001 einer naturgegeben schon fast sicher verbesserten Verträglichkeit bei dennoch sehr nennenswerter Immun- bzw. Infektionsabwehr somit in der praktischen Anwendung tatsächlich in dieser Weise bestätigen (wobei dabei aber immer noch auch dessen Wirkungseffizienz gegen alle Virus-Mutationen, insbesondere die weiterhin aggressivste Form der Delta-Mutationsvariante kritisch abzuwarten bliebe), hätte dieses Vakzin von VALNEVA unseres Erachtens vom medizinischen Standpunkt in der Tat her künftig jegliches Potenzial, ein ernstzunehmender Konkurrent zu allen bisherigen Aktivvirus-mRNA/Vektor-Impfstoffen einer BIONTECH, MODERNA, ASTRAZENECA, JOHNSON & JOHNSON etc. zu werden.
Soweit, wie von vielen Medienvertretern derzeit öffentlichkeitswirksam postuliert, dass Valneva mit ihrer zweifellos vielversprechenden Entwicklung von VLA2001 bereits auf dem besten Weg zu einer künftigen „BioNTech 2.0“ sein könnte, wollen wir derzeit zwar noch keinesfalls gehen, da dies a) natürlich von weiterhin vorgelegten Test- bzw. realen Wirksamkeitsergebnissen nach internationaler Markteinführung abhängen wird und uns b) zwar eine Zulassung der europäischen EMA im Frühjahr als denkbar erscheint, keinesfalls aber eine von Valneva als wohl utopisch anvisierte Zulassung durch die britische Gesundheitsbehörde MRHA bereits zum Jahresende 2021, nachdem ja erst am 13.09. die britische Regierung den mit ihr geschlossenen Liefervertrag im Wert von 1,4 Mrd. EUR wegen angeblicher Vertragsverletzungen durch Valneva komplett stornierte.
Im Gegensatz zu BioNTech und Moderna Gewinnsteigerungen zumindest bis 2023 wahrscheinlich
Die vermeldeten Entwicklungsfortschritte von Valneva zur bisher ersten Totimpfstoff-Entwicklung auf Ganzkörperbasis (d.h. trotz überlegener Verträglichkeit dennoch Auslösung zumindest partieller körpereigener Immunreaktionen) erscheinen uns jedoch in jedem Fall als vielversprechend und plausibel genug, um Valneva in Einklang mit dem bisherigen Analystenkonsens nach einem netto weiter verlustbringenden Jahr 2021 (bereits ab dem 3. Quartal 2021 / Ergebnispublikation am 18.11. aber wohl bereits zumindest deutlich positiver operativer EBIT-Gewinn) bereits ab dem Jahr 2022 dann auch das dynamische Einschwenken in den positiven Nettogewinn-Bereich zuzutrauen.
Im Konsens wird von den Analysten Valneva daher für 2022 bereits die Erzielung eines Nettogewinns von rd. 156 Mio. EUR sowie in 2023 sogar von 203 Mio. EUR unterstellt, was damit dann auch in diametralem Kontrast zu dem von uns stets kritisch betonten, voraussichtlich massiven längerfristigen Nettogewinnrückgang von BioNTech (2021e – 2023e: rd. – 40 %) und Moderna (2021e – 2023e: rd. – 56 %) stehen würde.
 Vor diesem Hintergrund teilen wir ebenso den aktuellen Analysten-Konsens, dass (allerdings nur unter der alles entscheidenden Voraussetzung einer künftig ebenfalls fast flächendeckenden weltweiten Zulassung von VLA2001) der Valneva-Aktie mit einem rechnerischen KGV (2023e) von aktuell rd. 14,5 derzeit zumindest im Großen und Ganzen eine faire Bewertung beizumessen ist.
Vor diesem Hintergrund teilen wir ebenso den aktuellen Analysten-Konsens, dass (allerdings nur unter der alles entscheidenden Voraussetzung einer künftig ebenfalls fast flächendeckenden weltweiten Zulassung von VLA2001) der Valneva-Aktie mit einem rechnerischen KGV (2023e) von aktuell rd. 14,5 derzeit zumindest im Großen und Ganzen eine faire Bewertung beizumessen ist.
Folglich können sehr risikofreudig eingestellte Anleger, die künftig auf ebendiese nahezu lückenlose internationale Zulassung von VLA2001 setzen, momentan aus unserer Sicht durchaus auch weiterhin spekulative Käufe in der Aktie von Valneva in Erwägung ziehen.
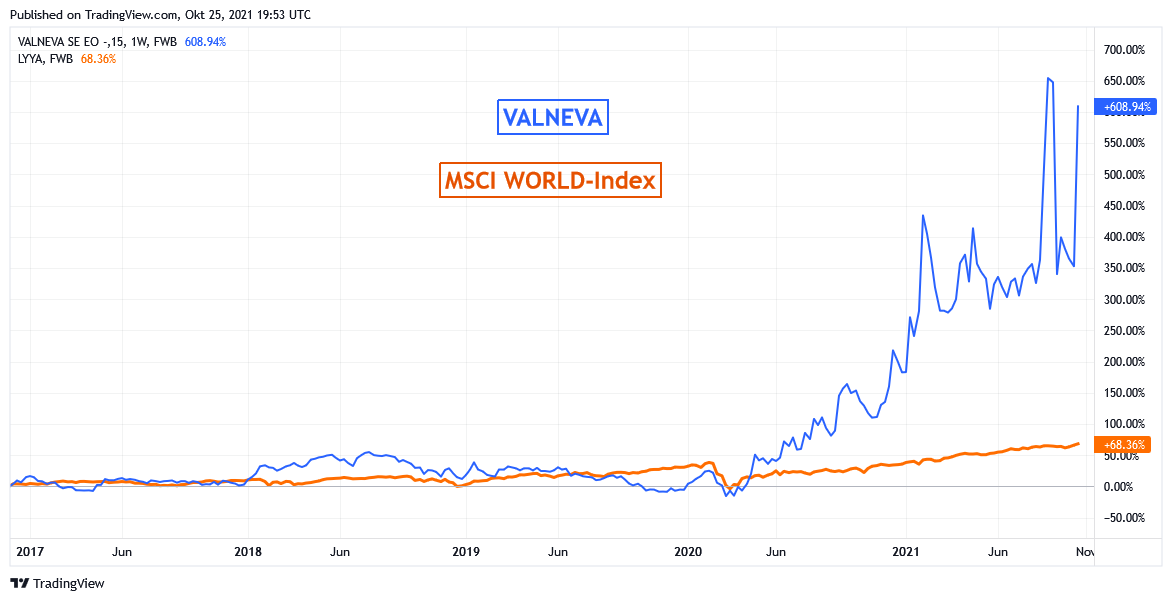
Chart: VALNEVA gegen MSCI WORLD (Euro)-Index
25.10.2021 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)






 14.09.2024
14.09.2024
 14.11.2023
14.11.2023
 14.11.2023
14.11.2023
 15.08.2023
15.08.2023